
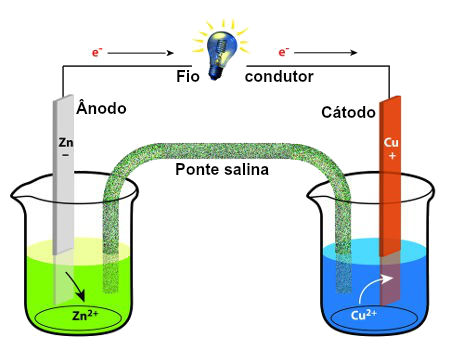
A Eletroquímica é a ciência base por trás da maioria dos equipamentos da linha PAR e Solartron. Basicamente, estuda todas as reações que envolvem troca de cargas, normalmente elétrons. A pilha de Daniell é o exemplo mais clássico de reação eletroquímica. Durante a descarga, os elétrons são transferidos na seguinte ordem: zinco (metálico) -> cobre (metálico) -> sal de cobre. Ao retirar elétrons do zinco, ele se oxida (corrói) e vai para a solução na forma de sal de zinco (ZnSO4). O sal de cobre (CuSO4) aceita os elétrons provenientes do Zn e se reduz, gerando cobre metálico.
Da mesma maneira, existem muitas outras reações eletroquímicas no cotidiano. Elas podem ser classificadas em dois tipos: espontâneas e eletrolíticas. Outras reações espontâneas bastante óbvias são as pilhas e baterias. Por outro lado, reações envolvendo oxigênio, tais como combustão (queima) e corrosão (ferrugem) também são reações eletroquímicas espontâneas. As reações eletrolíticas são aquelas que ocorrem de maneira ‘forçada’, também chamadas de eletrólise. Nesse caso é necessário aplicar uma corrente ou potencial para que ela ocorra. Os exemplos mais comuns são banhos metálicos (de ouro, galvanização), produção de alumínio e purificação de vários metais.
O que é potencisotato?
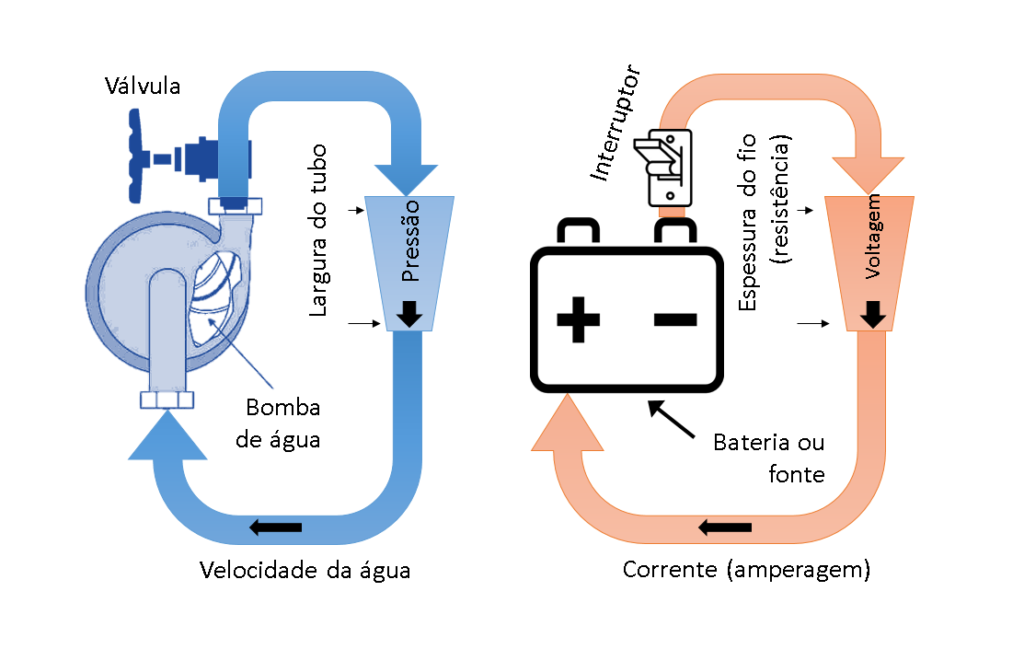
O potencial (também chamado de voltagem) e a corrente (também chamada de amperagem) são as principais grandezas presentes na pesquisa em Eletroquímica. Segue um exemplo prático para entender o que são elas:
Uma bomba de água pode promover um fluxo de água, assim como uma bateria pode promover um fluxo de elétrons, basta que eles estejam conectados a um sistema de tubos, no caso da água, ou de fios, no caso da bateria. O fluxo pode ser ligado ou desligado por uma válvula (torneira), no caso da água, ou por um interruptor (tomada) no caso dos elétrons. A velocidade e a pressão do fluxo são determinados pela largura do tubo, assim como a voltagem e amperagem são determinados pela espessura do fio (ou resistência). Portanto, a corrente elétrica não é nada mais que a velocidade dos elétrons, ao passo que a voltagem é um tipo de ‘pressão’ que os elétrons fazem para fluir.
Uma célula eletroquímica é dividida em: 1) Eletrodos: onde ocorre a troca de elétrons entre as moléculas e o circuito; 2) Circuito Externo: onde ocorre a condução eletrônica entre os eletrodos; 3) Eletrólito: onde ocorre a condução de íons entre as espécies. O potencial só existe entre dois eletrodos. Um eletrodo não é necessariamente metálico, pode ser qualquer material que não se misture com o eletrólito. Na denominação padrão, uma célula de 2 eletrodos é formada por um WE e um CE. Por vezes, o CE é chamado de Eletrodo auxiliar. Na célula de 3 eletrodos, um RE é adicionado ao sistema. Existe, ainda que muito pouco utilizado, um sistema de 4 eletrodos, onde o quarto é chamado de RE2 ou S (sense).
O potenciostato serve para controlar o circuito externo, como a lâmpada o faz no exemplo da pilha. A partir de dados de corrente e potencial, as reações podem ser estudadas. No desenvolvimento de baterias, por exemplo, busca-se obter maior voltagem e corrente, ao passo que a corrosão é o oposto, busca-se revestimentos que protejam a corrosão, diminuindo a corrente e potencial. Entretanto, uma fonte de alimentação programável, aliado a amperímetros e voltímetros, fariam essa mesma função por um custo muito menor. Então qual a vantagem do potenciostato? Veja a seguir.
A principal diferença entre um potenciostato e uma fonte programável é o circuito que permite adicionar eletrodos de referência. Um valor de voltagem ou corrente não existe sozinho, é sempre medido entre dois pólos. Assim, utilizando apenas uma fonte, o pesquisador não conseguiria distinguir qual dos pólos é o verdadeiro responsável pelas variações observadas. É nesse ponto que entra o potenciostato, fornecendo um circuito capaz de medir o potencial entre o WE e o RE. Ele faz a corrente passar praticamente (mais de (99,99%) entre WE e CE deixando o RE estável e confiável.
A eletroquímica é uma ciência multidisciplinar, presente em diversas áreas de pesquisa e desenvolvimento. Laboratórios que contêm nomes como eletroquímica, corrosão, células a combustível e baterias certamente necessitam de potenciostatos. Ademais, várias outras áreas da química, física e engenharias utilizam o potenciostato como ferramenta para explorar processos redox ou eletrônicos.

